肿瘤的守护者还是破坏者?中性粒细胞的双重角色

中性粒细胞是抵御微生物感染的第一道防线。它们是人类血液中循环最丰富的细胞,并被迅速招募到组织损伤的部位。长期以来,人们一直认为,循环中的中性粒细胞,主要是由于它们成熟后无法增殖,会迅速耗尽,因此在动态平衡条件下的半衰期很短。这导致了一种观点,即中性粒细胞是专门的细胞,只完成一组特定的免疫防御功能。因此,中性粒细胞的功能多样性还没有像对其他髓系细胞那样深入研究。
之前我们也写过中性粒的相关内容,感兴趣的可以点击查看→聚焦中性粒细胞胞外诱捕网(NETs)
近年来,中性粒细胞受到了越来越多的关注,旧的观点受到了挑战。最近对中性粒细胞生物学的重新评估在很大程度上要归功于技术进步,例如活体成像、高维转录和表观基因组学方法以及在单细胞分辨率下进行的研究。这些新的策略不仅使我们能够剖析免疫相关疾病中性粒细胞基因表达的调节,还揭示了不同健康组织之间和随着时间的推移中性粒细胞的高度异质性。在癌症中,肿瘤相关中性粒细胞(TANs)已成为肿瘤微环境(TME)的重要组成部分。在这里,他们可以发挥促肿瘤和抗肿瘤的双重作用。
TANs到底是肿瘤的守护者还是破坏者?这篇文章带你一起来揭秘!
中性粒的分化
1
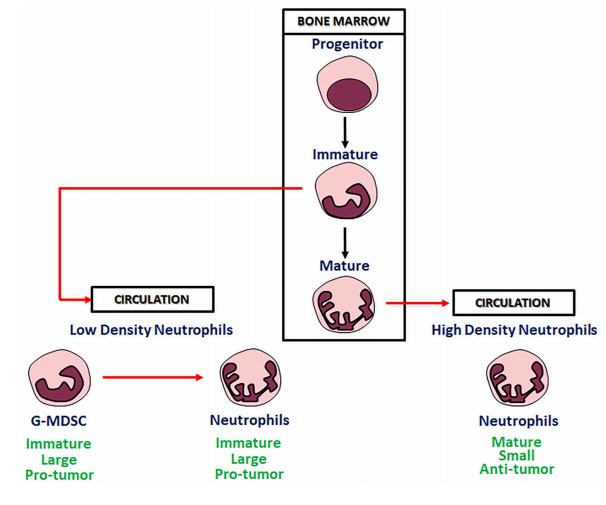
在稳态状态下,人每天产生1×1011-2×1011个中性粒细胞,小鼠每天产生1×107个中性粒细胞。
造血干细胞(HSCs)分化为共同的髓系祖细胞(CMPS),从而产生粒-单核细胞祖细胞(GMPs)。中性粒细胞和单核细胞的分化是通过表达特定的转录因子来调控的,其中CCAAT/增强子结合蛋白-ε(C/EBPε)和生长因子非依赖性1(GFI1)驱动中性粒细胞的产生,C/EBPα和PU.1驱动单核细胞的产生。
GMP向中性粒细胞的分化受骨髓基质细胞[即粒细胞集落刺激因子(G-CSF)和粒细胞-巨噬细胞集落刺激因子(GM-CSF)]表达的调节,并始于成髓细胞的形成。然后,成髓细胞分化为早幼粒细胞,随后产生髓细胞、偏粒细胞、带状中性粒细胞,最后形成成熟的中性粒细胞。这种分类是基于组织学染色和电子显微镜分析。最近使用scRNA-seq和CyTOF的研究进一步表征了中性粒细胞的发育,并确定了中性粒细胞分化过程中的多个离散步骤。增殖的中性粒细胞定位的骨髓细胞的两个亚群,被称为早期中性粒细胞祖细胞(NePs)和前中性粒细胞(PreNeus),NePs可能是preNeus的前驱。
重要的是,人的中性粒细胞是单能的,在过继转移到免疫缺陷小鼠后只产生中性粒细胞。在癌症中,不同的中性粒细胞亚群由未成熟细胞和成熟细胞组成,可能具有免疫抑制和促肿瘤活性,出现在循环和肿瘤部位。

TME与TANs
2
肿瘤细胞和肿瘤相关巨噬细胞等释放出趋化因子CXCL-1/2/5/6/8和CCL-3/5等,这些因子吸引外周血中的中性粒细胞向肿瘤局部微环境迁移,并在微环境中分化成不同的TANs。

在TME中的细胞因子信号和表观遗传学信号的作用下,中性粒细胞发生极化,转变为抗肿瘤的N1型TAN,也会形成促进肿瘤发展的N2型TAN。
中性粒细胞在IFN-β、IL-1β、IL-8和TNF-α等细胞因子的影响下,向N1型极化。N1型中性粒细胞表现出短寿命、成熟的表型、高细胞毒性和高免疫活性,并能促进CD8+ T细胞的活化。
当受到TGF-β、IL-8、IL-6和IL-17等细胞因子的作用时,中性粒细胞会向N2型极化。N2型中性粒细胞具有长寿命、不成熟表型、低细胞毒性,并促进肿瘤的生长、浸润、转移、血管新生,同时抑制免疫反应。

肿瘤中性粒细胞分化和激活状态,包括TANs和粒细胞髓系衍生抑制细胞(G-MDSC或者PMN-MDSCs),目前尚无统一的命名方法。与肿瘤相关巨噬细胞的M1和M2二分法类似,N1和N2命名法被引入来定义具有抗肿瘤和促肿瘤功能的中性粒细胞。然而,N1和N2的定义不能与其他更广泛使用的极化免疫反应的1型和2型二分法(例如,Th1和Th2细胞;1型和2型免疫;M1和M2;ILC1和ILC2)相提并论,因为与这些细胞相比,IFN-γ、IL-12和IL-4不是中性粒细胞功能极化的关键驱动因素。
根据人CD11b和CD66b在SSChighCD45+白细胞上的表达,以及在Ly6ClowLy6Ghigh在小鼠CD11b中的表达,代表了明确识别中性粒细胞的最小表面分子集。这个广义的表型定义包括不同的亚群,包括未成熟的中性粒细胞、成熟的中性粒细胞、老化的中性粒细胞和表达一组干扰素刺激基因的中性粒细胞,我们分别称之为NI、NM、NA和NISG。MDSCs被定义为一种异质性群体,主要是未成熟的髓系细胞,其免疫抑制活性与中性粒细胞(G-MDSCs)或单核细胞(M-MDSCs)分化途径有关。由于MDSCs的典型特征是基于其功能,我们建议G-MDSCs应该指已证实具有免疫抑制活性的中性粒细胞群体。

昼夜节律振荡和衰老影响中性粒细胞蛋白质组,包括趋化因子受体、模式识别受体和参与粘附的分子、炎症体和囊泡转运以及中性粒细胞胞外诱捕网(NETs)的产生和迁移能力。中性粒细胞的多样性可能是对分化和环境信号的可塑性反应的结果。
下图是TME中中性粒细胞的命名图谱:
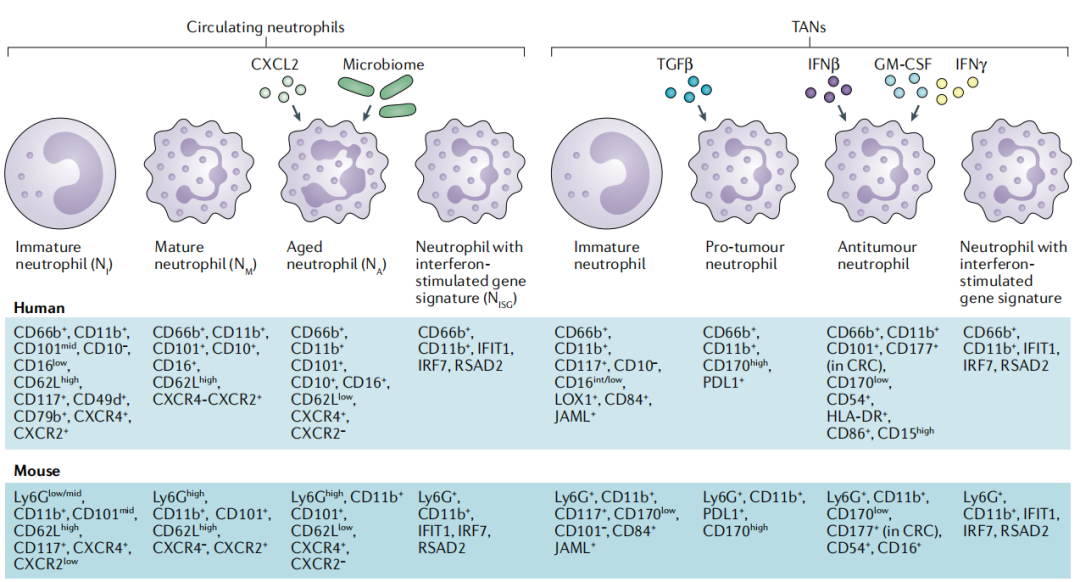
下表是TANs和MDSCs的一些指标差异:

TANs双重功能
3
促肿瘤作用
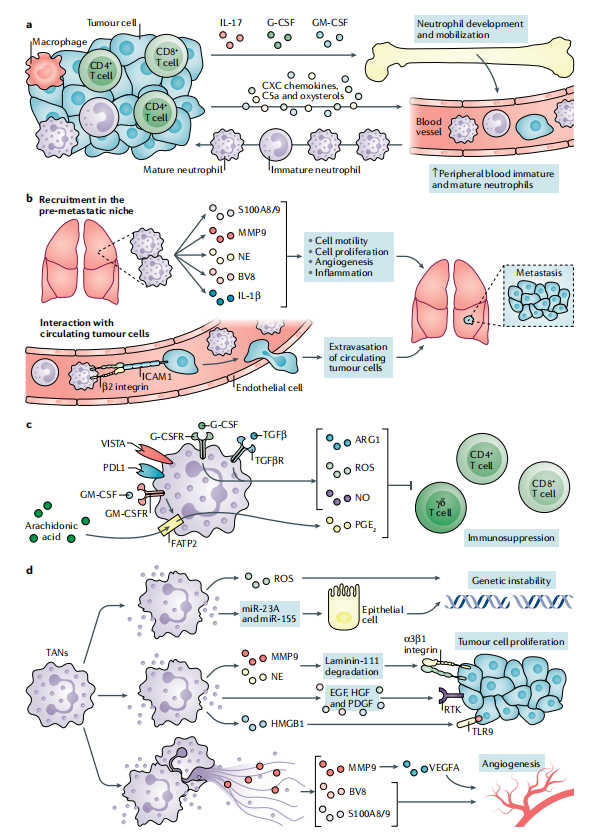
中性粒细胞可以通过不同的机制维持肿瘤生长,包括抑制T细胞活化、促进遗传不稳定性、肿瘤细胞增殖、血管生成和转移。
a>>>生长因子、IL-17、补体成分C5a、氧化甾醇和CXC趋化因子的产生驱动中性粒细胞的产生、募集和存活。
b>>>趋化因子诱导中性粒细胞在转移前生态位中动员,通过产生几种介质来维持转移细胞的到达。循环中性粒细胞通过整合素介导的直接相互作用促进循环肿瘤细胞存活和外渗。
c>>>肿瘤微环境中存在的分子,包括G-CSF和TGF-β,通过中性粒细胞诱导ARG1、ROS和NO的表达,抑制 T 细胞的激活。GM-CSF诱导中性粒细胞中FATP2的表达。FATP2促进花生四烯酸的摄取和PGE2的合成。中性粒细胞表达PD-L1和VISTA。
d>>>中性粒细胞通过产生ROS和释放含有microRNA miR-23A和miR-155的微粒来诱导遗传不稳定,从而下调参与维持核完整性的分子的表达。中性粒细胞通过产生EGF、HGF和PDGF来维持肿瘤增殖,释放含有MGB1的NETs,激活癌细胞中TLR9依赖性途径、中性粒细胞弹性蛋白酶(NE)和MMP9可裂解laminin 111。裂解的laminin 111通过激活整合素信号传导触发癌细胞增殖。中性粒细胞通过释放促血管生成因子BV8、S100A8和S100A9以及MMP9(激活细胞外基质中的血VEGFA)来维持肿瘤血管生成。
抗肿瘤作用
中性粒细胞参与不同的抗肿瘤耐药机制,包括激活T细胞依赖性抗肿瘤免疫、针对肿瘤细胞的直接细胞毒活性或抗菌活性。
a>>>抗肿瘤适应性免疫的激活:TME中存在的IFN-γ和GM-CSF促进未成熟中性粒细胞成熟为表达MHC I类和II类的抗原呈递细胞 (APC),表达共刺激分子CD86、4-1BBL和OX40L。
b>>>肿瘤细胞杀伤:不同的刺激,如G-CSF、趋化因子(CXCL8、CXCL5、CCL2)、LPS和IFN-β 促进中性粒细胞的氧化破裂和过氧化氢的产生。通过TGF-βR阻断信号传导(使用小分子抑制剂SM16)可增强过氧化氢的产生。反过来,过氧化氢会触发肿瘤细胞中的细胞内信号传导途径,导致非选择性阳离子通道瞬时受体电位阳离子通道、TRPM2的激活和开放,从而诱导致命的钙流入(Ca2+)进入癌细胞。HGF作用于中性粒细胞表达的HGFR,也称为MET,促进诱iNOS的表达。反过来,iNOS 会诱导NO的释放,从而杀死肿瘤细胞。
c>>>控制微生物:在结直肠癌 (CRC) 中,中性粒细胞中通过IL-1R1发出的信号增强其抗菌活性,从而限制细菌驱动的炎症和结直肠癌的发展。
d>>>抗肿瘤UTCαβ的激活:中性粒细胞与巨噬细胞和CD4–CD8–TCRαβ+双阴性非常规T细胞(UTCαβ)进行三方相互作用。中性粒细胞放大巨噬细胞产生的IL-12,进而促进UTCαβ向1 型免疫反应极化和IFN-γ的产生。这些细胞的特征是表达TCRαβ、IL-12R、IL-18R、与其先天样表型相关的分子[例如Ly49和CD94–NK细胞受体G2 (NKG2)]和IFN-γ。

中性粒细胞靶向肿瘤治疗机制
4
a>>>中性粒细胞表达一组骨髓检查点,包括SIRPα、CD200R、LILRB2、PILRα、PD-1和ACKR2。临床前模型中已经确立了针对中性粒细胞的SIRPα、LILRB2和ACKR2的重要性。然而,阻断 CD200R、PILRα241和PD1的潜在抗肿瘤作用尚未得到类似的证明。中性粒细胞还表达一组淋巴细胞检查点的配体(即 VISTA、PD-L1、CD86、4-1BBL和OX40L),代表限制癌症中中性粒细胞介导的免疫抑制过程的潜在目标。与T细胞表达的同源受体(分别为 PSGL1、PD-1、CTLA4、4-1BB 和 OX40)相互作用,产生阳性 (+) 或向T细胞发出负(-)信号,取决于特定的受体-配体配对。
b>>>抑制CXCR1或CXCR2可抑制癌症中免疫抑制性中性粒细胞的募集。
c>>>阻断TGF-βR、IFN-β信号传导或拮抗AGTR1可以增加中性粒细胞对癌细胞的细胞毒活性。CXCR4阻断会增加中性粒细胞IL-18的产生以及NK细胞的激活。最后,中性粒细胞的免疫抑制作用可以通过阻断FATP2来削弱,FATP2响应花生四烯酸,诱导PGE2的合成。
d>>>中性粒细胞表达IgG Fc 受体(FcγR)和IgA Fc受体 (FcαRI),并通过抗体依赖性细胞毒性(ADCC)过程参与消除抗体调理的癌细胞。

总而言之:抑制或阻断N2 TAN促肿瘤极化的细胞因子信号通路,促进或激活N1 TAN抗肿瘤极化的细胞因子信号通路,显然是策略的核心。
TANs作为许多肿瘤预后指标的评估已得到明确评估:高TAN数量和/或升高的中性粒细胞与淋巴细胞比率(NLR)确实与患者的不良预后相关。由于TANs在进展和转移中发挥关键作用,因此建议以TAN为治疗靶点,并且已经完成了许多临床前研究。相反,由于它们在防御感染方面的作用和免疫抑制的风险,难以抑制其作用,迄今为止已经进行了一些临床试验。因此,未来有必要将继续探索TAN在肿瘤中的作用机制及其在免疫治疗中的治疗策略。
好啦,最后小编也为大家整理了《中性粒细胞:异质性与标志物》,大家可以扫描下方二维码免费领取!


滑动查看参考文献
加入社群


关于福麦斯









